Podemos verlo en la tabla periódica de whizzy.
Los científicos se preguntaron ¿Cómo giraban? ¿Donde estaban situados los electrones?
Para responder a estas preguntas utilizaron dos sistemas:
a) el estudio de la luz que emiten los átomos.
b) arrancar electrones de un átomo.
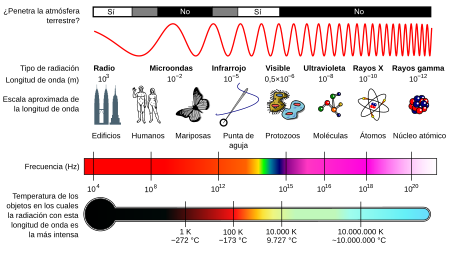 Para estudiar la luz hay que descomponerla en sus colores. cada color corresponde a una frecuencia y la mezcla de estos colores primarios produce todas las luces que vemos en la naturaleza. Además de la luz visible existen ondas (similares a la luz) que no podemos percibir con la vista pero si disponemos de instrumentos para detectarlas y medirlas. En el dibujo observamos el espectro electromagnético, es decir el conjunto de ondas parecidas a la luz. A cada tipo de onda le corresponde una frecuencia y además incluímos la temperatura que tenemos que tener para emitir ese tipo de ondas. Para emitir luz visible un objeto necesita estar a 8000ºK, para emitir luz infraroja la temperatura basta con que sea 300ºK.
Para estudiar la luz hay que descomponerla en sus colores. cada color corresponde a una frecuencia y la mezcla de estos colores primarios produce todas las luces que vemos en la naturaleza. Además de la luz visible existen ondas (similares a la luz) que no podemos percibir con la vista pero si disponemos de instrumentos para detectarlas y medirlas. En el dibujo observamos el espectro electromagnético, es decir el conjunto de ondas parecidas a la luz. A cada tipo de onda le corresponde una frecuencia y además incluímos la temperatura que tenemos que tener para emitir ese tipo de ondas. Para emitir luz visible un objeto necesita estar a 8000ºK, para emitir luz infraroja la temperatura basta con que sea 300ºK.
La relación entre la luz y los electrones de un átomo es sencilla.
Sabemos que la luz es una onda electromagnética y que para producirla
hace falta hacen falta cargas eléctricas que vibren o que se muevan
aceleradamente. La luz que vemos, los colores del arco iris, y el
conjunto de ondas electromagnéticas que no vemos (desde los
ultravioletas a los rayos gamma, desde los infrarojos a las ondas de
radio) tiene su origen en el movimiento de electrones.
Los electrones de un átomo reciben energía (por medio de calor, luz, electricidad etc) y saltan a órbitas exteriores. Cuando los electrones están en órbitas exteriores emiten energía en forma de luz (más energía, más frecuencia, colores más violetas) y caen a órbitas interiores. La observación de la luz que emite un átomo nos informa de la situación de las órbitas o niveles energéticos posibles para alos electrones.
Podemos ver en esta animación como ocurren estos saltos.
Los elementos químicos en estado gaseoso y sometidos a temperaturas elevadas o alta tensión producen espectros discontinuos en los que se aprecia un conjunto de líneas que corresponden a emisiones de sólo algunas longitudes de onda. El siguiente gráfico muestra el espectro del Na (sodio):

El conjunto de líneas espectrales que se obtiene para un elemento concreto es siempre el mismo, incluso si el elemento forma parte de un compuesto complejo, y cada elemento produce su propio espectro diferente al de cualquier otro elemento. Esto significa que cada elemento tiene su propia firma espectral. Estos colores nos permiten calcular las diferentes órbitas de un átomo, las diferentes posibilidades que tiene un electrón para situarse.
En esta página web puedes observar espectros de todos los átomos.
Todo esto nos permite afirmar que los electrones del átomo (responsables de la emisión de luz al recibir energía) no están colocados de cualquier forma sino que en cada átomo se encuentran situados de una forma definida y estable que proporciona siempre el mismo espectro.
Cada átomo emite luz con unos colores determinados. Esto permite detectar la existencia de átomos en una muestra desconocida. Así los científicos lograron detectar un elemento químico, desconocido en la Tierra, en el Sol. Observando la luz que proviene del Sol descubrieron un espectro desconocido hasta entonces. Así el Helio se descubrió en el Sol antes que en la propia Tierra. Así podemos decir que los átomos que forman el Universo entero son los mismos que tenemos en la Tierra.
La espectroscopía es actualmente la más poderosa herramienta de detección de átomos y moléculas. También las moléculas emiten luz y estudiando los colores y su intensidad podemos conocer con precisión increíble las moléculas existentes en una mezcla o incluso detectar moléculas desconocidas.


No hay comentarios:
Publicar un comentario