1 - En un generador portátil de hidrógeno, se hacen
reaccionar 30 g de hidruro de calcio con 30,0 gramos de agua, según la reacción:
CaH2 +
H2O --- Ca (OH)2 + H2
Después de ajustar la reacción, calcula:
a)
Que reactivo sobra y en que cantidad.
b)
El volumen de hidrógeno que se produce, medido a 20 ºC y 745 mmHg.
c)
El rendimiento de la reacción si el volumen real producido fue 34
litros.
a) Masa de hidrógeno necesaria.
b) Los moles de nitrógeno necesarios.
c) ¿Qué ocurriría si el rendimiento de la reacción es del 83%.
3- Un mineral de hierro contiene un 34,6 de
de 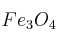 siendo el resto impurezas
siendo el resto impurezas
Se quiere obtener Hierro tratando el óxido con monóxido de carbono.
¿Cuántas toneladas de mineral se deberían procesar para obtener 1 tonelada de hierro metálico, si el rendimiento es del 80 ?
?
b) Los moles de nitrógeno necesarios.
c) ¿Qué ocurriría si el rendimiento de la reacción es del 83%.
3- Un mineral de hierro contiene un 34,6
Se quiere obtener Hierro tratando el óxido con monóxido de carbono.
¿Cuántas toneladas de mineral se deberían procesar para obtener 1 tonelada de hierro metálico, si el rendimiento es del 80
4- Una muestra contiene hidróxido de sodio; 98 gramos de la muestra reaccionaron
con 1 mol de ácido sulfúrico. ¿Cuál es el porcentaje de hidróxido de sodio
en la muestra?.
5-Calcula el volumen de hidrógeno, medido en condiciones
normales, que se obtendrá tratando con ácido clorhídrico, 20,0 g de cinc metálico
del 70% de pureza.
6- Dada la reacción, representada por la ecuación:
H2S (aq)
+ Ca(OH)2 (aq) ®
CaS + H2O
a)
Ajústala.
b)
Calcula la cantidad, en gramos, de Ca(OH)2 necesaria para
reaccionar con 0,1 moles de ácido sulfhídrico.
c)
¿Qué volumen de disolución 0,2 M de hidróxido de calcio se necesitaría
para que reaccionase con 0,1 moles de ácido sulfhídrico
No hay comentarios:
Publicar un comentario