2Fe2O3 + 3C → 4 Fe + 3 CO2
En masa 319,4 g
+ 36g 223,4g 132g
Ponemos 30 kg de óxido y 5 kg de carbono …… voy a ver cuanto reacciona con 30 kg de
óxido
X= 36.30/319,4= 3,38 kg de carbono
como he puesto 5 kg de carbono me sobran 5-3,38= 1,62kg de
carbono.
El reactivo limitante es el óxido de hierro y me sobra
carbono.
Para calcular cuanto hierro se obtiene puedo partir de los
30 Kg de óxido o de los 3,38 g de C
X= 223,4. 30/319,4=
20,93 kg de hierro
Problema 8 Página 299;
NaOCl (aq)
+ 2 NH3 (aq) → N2H4
(aq) + NaCl (aq) + H2O (l)
En masa 74,5 g
+ 34g 38g 58,5g 18g
Si partimos de 620,8
g de hidracina , NaOCl deberíamos
obtener de N2H4:
X= 620,8 . 38 /74,5 = 316,65 g pero solo obtenemos 216,2 g es decir tenemos un rendimiento de: Si de 316,65 obtenemos 216,2
De 100 ---------- x x= 100 . 216,2/316,65 =
68,29% de rendimiento
Me da la impresión que la solución del libro está
equivocada.
Problema 11 Página 301
El freón contiene Cl; F y C
pero no sé los subíndices. Es decir el número (moles) de átomos que
entran en el compuesto. Primero tendré que calcular los moles de cada elemento:
0,992/12 = 0,0827
moles de C
5,88/35,45= 0,166 moles de Cl
3,14/ 19 = 0,165 moles de F
Estoy buscando números enteros que guarden esa proporción.
Divido por el más pequeño:
C.. 0,166/ 0,0827 = 827/0,827
= 1
Cl.. 0,166/0,827 = 2
F.. 0,165/0,827 =
2
La fórmula empírica que es la más sencilla posible que
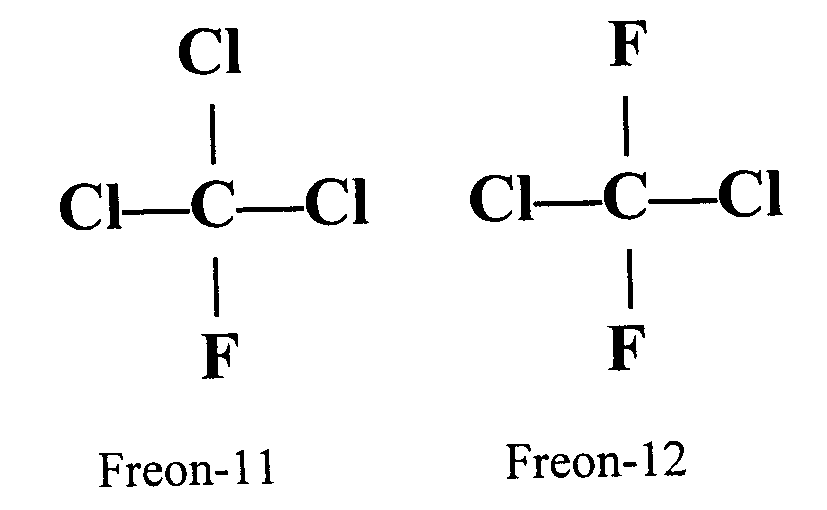
cumple esa proporción es CCl2F2
Qué además coincide con la molecular como podemos ver en el
dibujo de la molécula.
Recuerda que puedes subir las soluciones utilizando el nombre y contraseña que hemos visto en clase.
Si no sabes hacer los problemas debes buscar información en el libro y si sigues sin saber buscar una tarea alternativa en el libro o en Internet.
No hay comentarios:
Publicar un comentario