Los científicos querían observar el el átomo ¿Cómo estaba conformado el átomo? Pero el átomo es invisible a los sentidos y a los más sofisticados microscopios.
A principios del siglo XX los átomos tenían un problema similar al de unos policias que intentan averiguar el contenido de una caja de cartón de la que sospechan que guarda en su interior algo más que la gomaespuma que han declarado sus propietarios. La policia podría usar un escaner, pero en ausencia de este podrían intentar taladrar la caja con agujas muy finas que pudieran dar información sobre el interior de la caja.
Las agujas tienen que ser muy finas para poder sacar el contorno de las armas del interior con precisión.
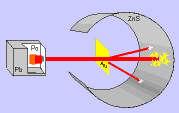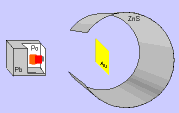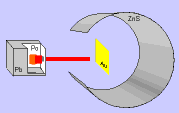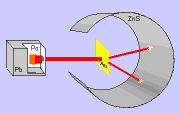 Al equipo dirigido por Ernest Rutherford de la Universidad de Cambridge le cupo el honor de dar la solución con un experimento crucial. Usaron las partículas alfa recien descubiertas como proyectiles para investigar el átomo por dentro.
Al equipo dirigido por Ernest Rutherford de la Universidad de Cambridge le cupo el honor de dar la solución con un experimento crucial. Usaron las partículas alfa recien descubiertas como proyectiles para investigar el átomo por dentro. Usaron el Polonio descubierto por Madame Curie como fuente de partículas alfa. Las enfocaron sobre una lámina de oro (pan de oro) superfina. Conocían que la lámina podría tener un espesor de unos 200 átomos que corresponden a unas milésimas de milímetro. El oro se puede extender en "panes" de este increible espesor. Rodearon el oro con un detector circular de sulfuro de cinc.
Podemos ver esta animación para aclarar nuestras ideas.
¿Con qué chocaban las partículas alfa (positivas) y las repelía hacia atrás?¿Cómo era posible que el 99% de las partículas no se desviasen nada?
Rutherford publicó:
“Es la cosa mas increíble que me ha sucedido en la vida. Casi tan increíble como si disparase una pistola contra un papel de seda y el proyectil se volviese contra usted",
MODELO ATÓMICO DE RUTHERFORD:
La única posibilidad era crear un nuevo modelo átomico. El modelo de Thomson son podía ser cierto. En el modelo de Rutherford el átomo era semejante a un sistema solar en miniatura:
Un núcleo de tamaño muy pequeño en el centro, cargado positivamente y que tiene concentrada casi toda la masa del átomo. El núcleo que es 10000 veces más pequeño que el átomo tiene una densidad millones de veces superior a la materia sólida. Se dice que si el átomo tiene el tamaño de un campo de fútbol, el núcleo sería una naranja situada en su centro !y tiene toda la masa concentrada en el!. Los electrones muy ligeros se mueven alrededor suyo.
De hecho en las figuras de los libros el núcleo está muy exagerado. En realidad debería ser un punto casi invisible.
 El átomo, las moléculas que forman todo son en gran parte espacio vacío.
El átomo, las moléculas que forman todo son en gran parte espacio vacío.
 El átomo, las moléculas que forman todo son en gran parte espacio vacío.
El átomo, las moléculas que forman todo son en gran parte espacio vacío.
No hay comentarios:
Publicar un comentario